
Коллаген и его важность для здоровья и красоты кожи
Добавки на основе коллагена стали краеугольным камнем в управлении процессом старения, с доказанной способностью восстанавливать повреждения кожи, придавая молодой и здоровый внешний вид, необходимый в погоне за красотой. Коллаген является важным белком каркаса, который придает коже гладкость и эластичность, но с возрастом его выработка снижается. Поиск путей решения этой проблемы в настоящее время активно продвигается как эффективный способ преобразования кожи и волос, устраняя возрастные ухудшения. Растущее число научных исследований показывает захватывающие доказательства того, что можно омолодить стареющую или поврежденную кожу, улучшить функцию изношенных суставов и поддержать личное благополучие и жизненную силу. В последнее время исследования механизмов, влияющих на выработку коллагена в коже, и идеальной организации функциональных волокон, которые придают коже ее характерную эластичность и упругость, позволили по-новому взглянуть на то, как этот био-каркас может поддерживать клетки, ткани и органы. Факторы, влияющие на выработку коллагена в течение всей жизни (например, половое созревание, беременность, менопауза, андропауза), внутренние факторы (например, генетика, возраст, этническая принадлежность) и внешние факторы (например, УЛЬТРАФИОЛЕТОВОЕ излучение, загрязнение окружающей среды, курение), а также потенциал новых технологий, ингредиентов и устройств для восстановления компонентов коллагена и матрикса до их оптимального состояния улучшают способность осуществлять стратегии борьбы со старением с беспрецедентными результатами. В этой статье мы рассмотрим производство, структуру и функции коллагена кожи на протяжении всей жизни, подчеркивая его связь со здоровьем, внешним видом и красотой
Синтез и структура коллагена в коже
Синтез коллагена фибробластами
Коллаген обеспечивает опорную коллагеновую сетку , лежащую в основе здоровой кожи, и является ключевым фактором, определяющим сохранение упругости и эластичностикожи [1,2]. Тип I является основным коллагеном, содержащимся в коже, и составляет 80-90% коллагена кожи. Он вырабатывается клетками, называемыми фибробластами, которые относятся к мезенхимальному типу клеток, обнаруживаемым преимущественно в дерме[3]. Фибробласты также продуцируют белок эластина, который придает коже гибкость для растяжения, способствуя долгосрочной деформируемости, за которой следует отдача, позволяющая тканям вернуться к своей первоначальной конформации[4,5]. Это важнейшая функция для поддержания эластичности и упругости кожи [рис. 1]. Другим продуктом метаболической функции фибробластов является выработка гликозаминогликанов (ГАГ), которые представляют собой длинные неразветвленные гетерополисахариды, такие как гиалуронаты и сульфат дерматана (наиболее распространенный ГАГ в коже). Уникальное сочетание высокой вязкости, высокой гигроскопичности и низкой сжимаемости является ключом к их многочисленным функциям, включая поддержание необходимого содержания влаги в коже[6].
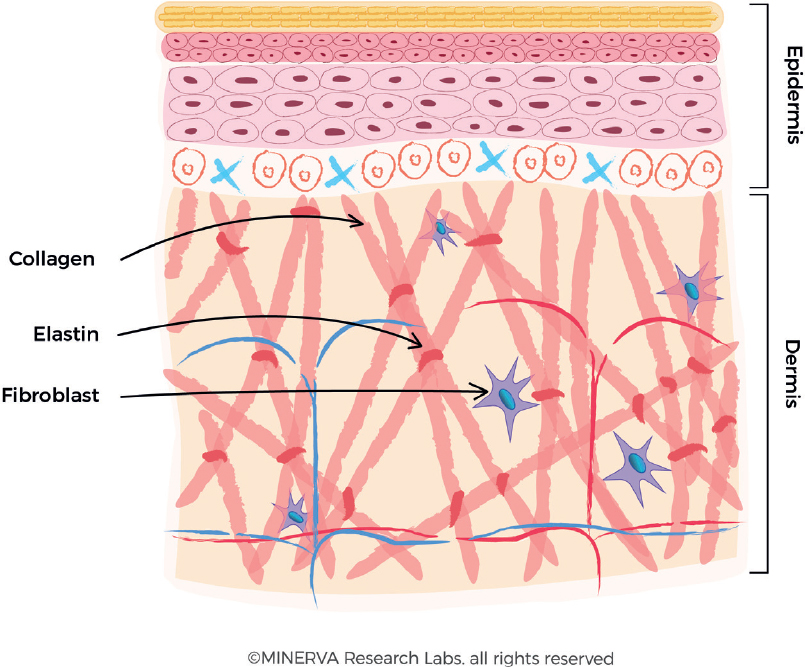
Рисунок 1. Производство коллагеновых волокон в дерме. Фибробласты секретируют проколлагеновые волокна во внеклеточный матрикс, где они образуют более крупные коллагеновые пучки. Эластин также секретируется и собирается в макромолекулярную структуру на основе коллагена. (С разрешения MINERVA Research Labs Ltd — Лондон)
Фибробласты чувствительны к физическому напряжению внеклеточного матрикса (ЭКМ), в который они встроены, а также к биохимическим стимулам и сигнальным путям, которые могут индуцировать активацию и пролиферацию фибробластов[7]. Небольшие по молекулярной массе диффузионные лиганды могут связываться с рецепторами, расположенными на внеклеточной мембране фибробластов, вызывая их активацию. Физическое напряжение в ЭЦМ может непосредственно вызывать активацию механорецепторов и закрепляющих фибрилл внутреннего каркаса цитоскелета и инициировать сигнальные пути, участвующие в коммуникации между клетками и ЭЦМ[8]. Активация фибробластов приводит к увеличению выработки коллагена, эластина и связанных с ними ГАГ[9].
Многие стратегии борьбы со старением направлены на то, чтобы повлиять на производство компонентов ECM фибробластами. Широкий спектр лигандов может влиять на пролиферацию и активацию фибробластов, включая биологически активные пептиды, антиоксиданты, ретиноиды, витамины, ω6 — и ω3-жирные кислоты, факторы роста, гидроксикислоты и множество растительных экстрактов[10-12]. Общая тема для большинства этих ингредиентов заключается в том, что они могут прямо или косвенно влиять на выработку коллагена и компонентов ECM.
С раннего возраста фибробласты становятся менее активными, а выработка коллагена снижается примерно на 1,0-1,5% в год[13,14]. Это также может усугубляться определенным образом жизни, таким как курение и внешние факторы, такие как воздействие солнца[15]. Продолжающееся воздействие солнечного света и загрязнения окружающей среды, а также снижение эффективности устранения химических веществ со свободными радикалами усугубляют ущерб. Многие исследования показали, что при попадании в организм коллагеновых пептидов (и других активных соединений) они будут перемещаться по всему организму, в том числе в места, где присутствуют фибробласты. Это стимулирует фибробласты вырабатывать больше коллагена, эластина и гиалуроновой кислоты, тем самым омолаживая кожу и другие ткани. Этот механизм является ключом к успешному производству коллагена, о котором сообщалось в клинических исследованиях после длительного использования добавок, и последующему улучшению эластичности и увлажнения кожи.
Недавнее исследование in vitro, проведенное Edgar et al.[16], показало, что гидролизованные коллагеновые пептиды значительно увеличивают синтез коллагена и эластина фибробластами, значительно ингибируя высвобождение двух коллагеназ, а именно металлопротеиназы-1 (ММП-1) и ММП-3. В ходе исследования в первую очередь изучалось взаимодействие между пептидами коллагена и другими компонентами (включая ГАГИ и антиоксиданты), присутствующими в гидролизованном нутрицевтике на основе коллагена, Gold Collagen® Forte, на нормальную первичную функцию фибробластов кожи. Эффекты добавления пептидов коллагена, отдельно или в сочетании с другими биологически активными и антиоксидантными компонентами, были протестированы и сравнены с эффектом только среды. Увеличение синтеза коллагена и эластина сопровождалось снижением активности ферментов ММП. Ферменты ММП ответственны за разрушение матрикса и деградацию эластина, а увеличение активности ММП связано с УФ-облучением и повреждением компонентов ЭЦМ свободными радикалами на основе активного кислорода[17,18]. Эти данные предоставили научное, основанное на клетках обоснование положительного влияния нутрицевтических добавок на основе коллагена на свойства кожи, предполагая, что усиленное образование стабильных дермальных фибробластов может последовать за их пероральным потреблением.
Образование и характеристика коллагеновых фибрилл
Существует около 28 различных форм коллагена, экспрессируемых в организме, из которых молекулярная биология, биохимия и структурные и архитектурные компоненты ECM были подробно рассмотрены Shoulders et al.[2,19] и в кратком обзоре Kadler et al.[20]. Семейство белков включает как фибриллообразующие, так и не фибриллообразующие белки, однако основными коллагенами, участвующими в архитектуре и физиологии кожи, являются фибриллообразующие типы, преимущественно тип I и тип III (римские цифры обозначают порядок открытия). Каждый белок кодируется серией генов, причем локусы генов для членов семейства коллагенов помечены аббревиатурой “COL”, а затем аннотацией как для типа коллагена, так и для составляющих цепей, например, COL1A1 для α1-цепи коллагена I типа[21]. Коллаген I типа, прототип, а также наиболее распространенный член, имеет длинноцепочечную структуру тройной спирали, состоящую из гетеротримера двух идентичных цепей al(l) и одной цепи α2(I) [рис.2]. Основным структурным детерминантом белка является тройная спиральная структура из трех полипептидных цепей с характерной аминокислотной последовательностью (Gly-X-Y), которая часто повторяется в структуре фибрилл, где Gly-глицин, а X и Y часто являются аминокислотами, такими как пролин и гидроксипролин[22].
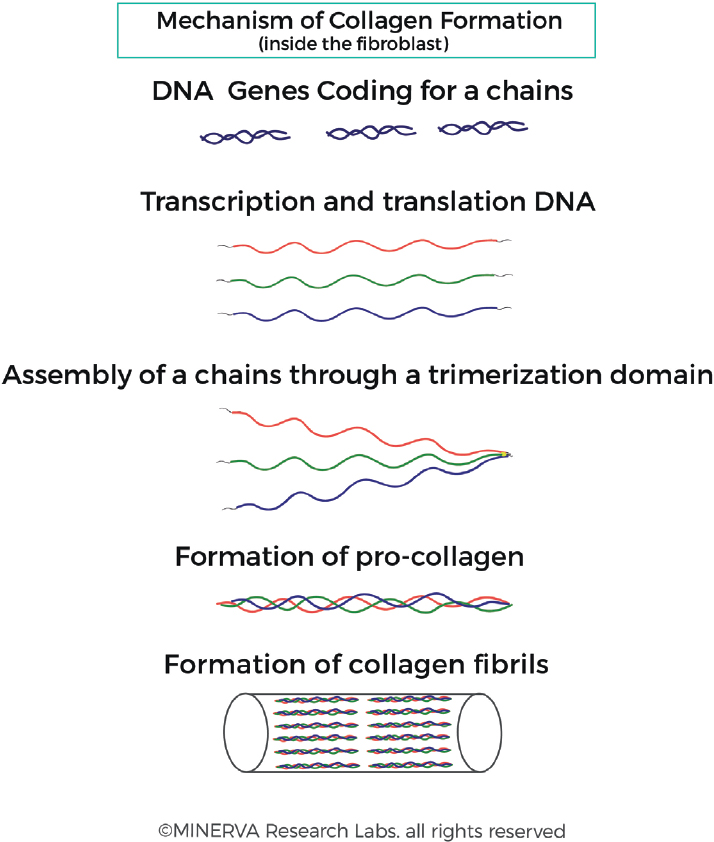
Рис. 2. Образование коллагеновых фибрилл. Гены коллагена транскрибируются в РНК и транслируются в белок в клетке фибробластов. Происходит посттрансляционная обработка, за которой следует связывание 3 отдельных цепей на С-конце. 3 цепи плотно связаны друг с другом и поддерживаются поперечными звеньями, которые стабилизируют структуру. Этот процесс тримеризации позволяет собирать α-цепи, которые далее собираются в фибриллы. (С разрешения MINERVA Research Labs Ltd — Лондон)
Гены, кодирующие альфа — цепи коллагенов, транскрибируются в РНК и транслируются в белок в эндоплазматическом ретикулуме клетки фибробластов и обрабатываются в секреторной везикуле. Связывание 3 отдельных цепей на С-конце инициирует образование тройной спирали, которая движется к N-концу подобно молнии [рис. 2]. Это позволяет собирать α-цепи в процессе тримеризации с образованием проколлагенов, которые далее собираются в фибриллы[23]. После секреции структуры тройной спирали коллагена в ЭЦМ происходит посттрансляционное расщепление N-и С — концевых пептидов [рис. 3].
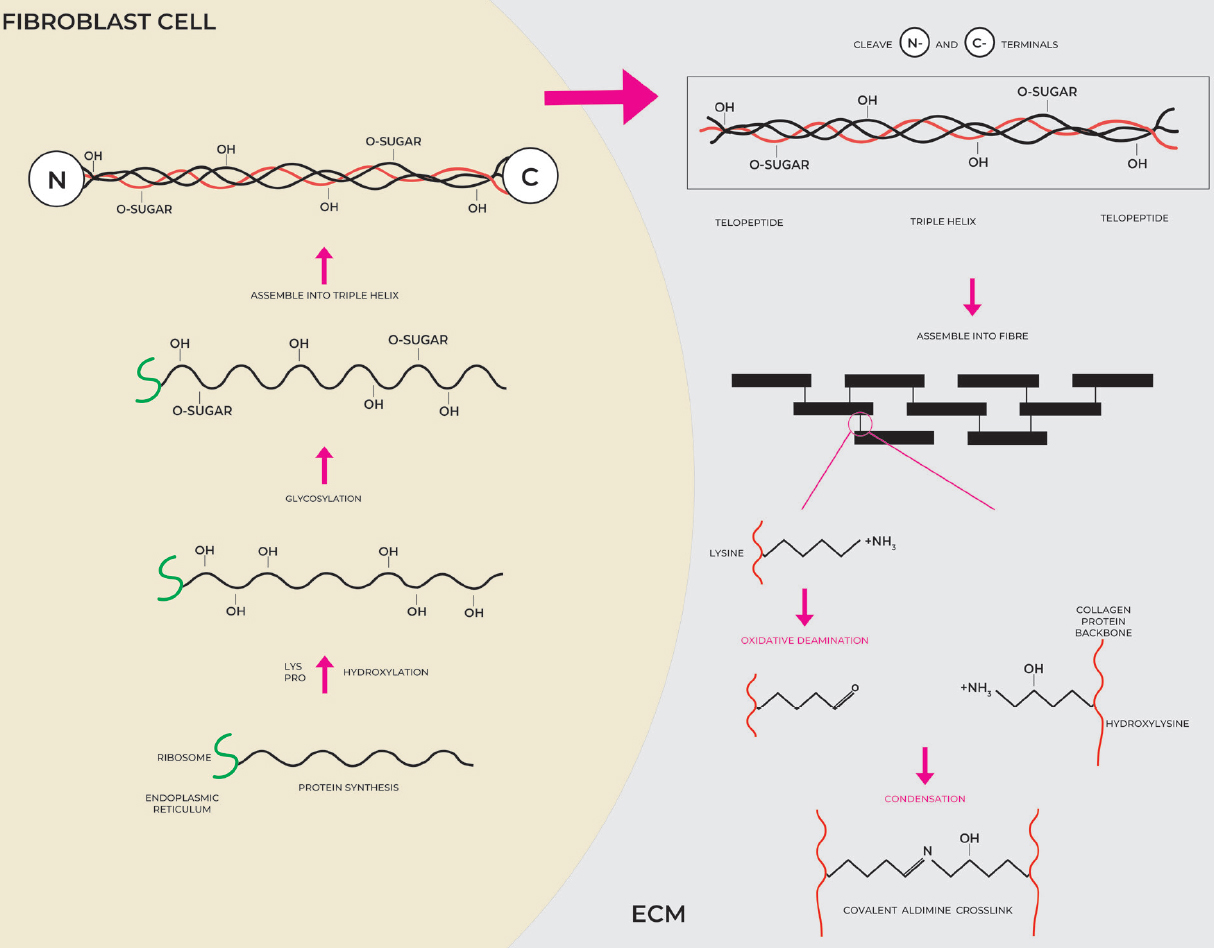
Рис. 3. Синтез коллагена, секреция в ЭЦМ и сшивание. Коллагены переводятся в белок на рибосомах эндоплазматического ретикулума внутри клетки фибробластов. Гидроксилирование и гликозилирование происходят до того, как 3 спиральные нити сплетаются вместе, образуя вид проколлагена. После секреции в ECM N-концевые и С-концевые концы расщепляются, и блоки тропоколлагена могут быть собраны в более крупную структуру, которые удерживаются вместе с помощью сшитых остатков между производным лизинового альдегида одной коллагеновой нити и соответствующим гидроксилизином противоположной нити. (С разрешения MINERVA Research Labs Ltd — Лондон)
Уникально высокое содержание аминокислот пролина (или, более конкретно, имино кислоты, в которой вторичный амин приводит к вращательно ограниченной жесткой кольцевой структуре, которая придает уникальную структурную стабильность) и лизина допускает целый ряд посттрансляционных модификаций за счет гидроксилирования остатков пролина и лизина[24]. Гидроксилирование лизина позволяет сшивать переплетенные волокна и придает нерастворимому белку уникальные характеристики, включая термическую стабильность, механическую прочность и трехмерную структуру, пригодную для производства спиральных волокон, которые очень устойчивы к различным механическим и биологическим силам, испытываемым в течение жизни [рис .3][25].
Коллаген I типа присутствует в коже, сухожилиях, сосудах, органах и костях (это основной компонент органической части кости, каркас, который впоследствии минерализуется для получения структуры, более прочной, чем сталь, и в то же время достаточно легкой, чтобы облегчить подвижность и скорость). Тип II преимущественно присутствует в хряще, веществе во много раз более гладком, чем стекло, с очень низким коэффициентом трения, но оно не хрупкое и не трескается под давлением. Тип III обычно встречается наряду с типом I и обычно составляет около 15% коллагена кожи. Это гомотример, состоящий из трех идентичных пептидных цепей α1.
Коллагеновые волокна образуют обширные и прочные сети, обеспечивающие дерме прочность, упругость и эластичность. Как показано на рис. 4, коллагеновое волокно обычно имеет диаметр до 3 мкм и имеет характерную спиральную структуру[2,26]. Коллагеновое волокно по существу состоит из пучков более мелких фибрилл. Коллагеновые фибриллы имеют диаметр от 10 до 300 нм и длину в несколько микрометров. Коллагеновая фибрилла представляет собой пучок трехцепочечных молекул коллагена (около 1,5 нм в диаметре и около 300 нм в длину). Эта спиральная структура с тройной спиралью является стереодинамически благоприятной для того, чтобы нити могли переплетаться друг с другом, и эта невероятно прочная структура может сохраняться в тканях в течение многих лет[27,28].
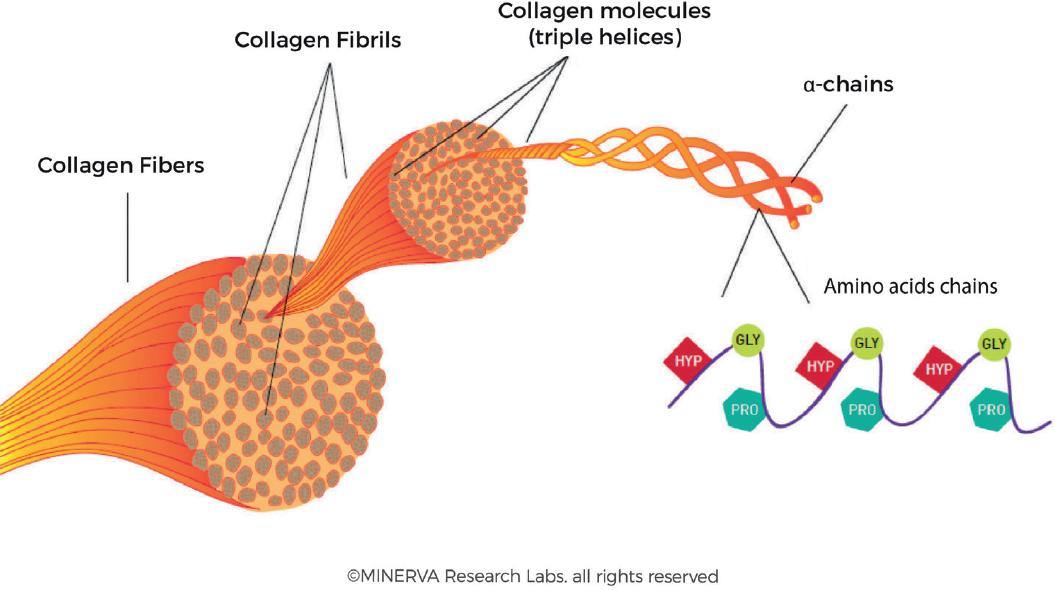
Рисунок 4. Организация коллагеновых фибрилл в пучки волокон. Отдельные α-цепи сплетаются в тройные спирали с помощью механизма застежки-молнии. Пучки тройных спиралей образуют фибриллы, и эти фибриллы объединяются в более крупные волокна. (С разрешения MINERVA Research Labs Ltd — Лондон)
Образование волокон зависит от взаимодействия с другими компонентами ECM, включая белки эластина и GAG. Все КЛЯПЫ, кроме гиалуроновой кислоты (ГК), связываются с коллагеном посредством электростатического взаимодействия в нормальных физиологических условиях[29]. Гипотеза заключается в том , что взаимодействие протеогликанов и коллагена непосредственно влияет на отложение коллагеновых волокон in situ, хотя для уточнения задействованных механизмов необходимы дальнейшие исследования. Таким образом, взаимодействие белка и GAG определяет синтез, секрецию и образование матрикса на основе коллагена, в то время как осмотическое равновесие в соединительной ткани определяется быстрым оборотом GAG, таких как ГК и сульфат дерматана[9,30].
Неинвазивные системы визуализации могут использоваться для визуализации и количественного определения коллагена в коже. Ультразвуковые устройства доступны для использования в клинических исследованиях в зависимости от требуемого применения и дизайна исследования, например, для измерения коллагена в коже по сравнению с сухожилиями, тестируемого участка тела (рука по сравнению с лицом), разрешения (мкм), чувствительности и глубины измерения кожи (папиллярная дерма по сравнению с ретикулярной дермой). Диапазон частот для визуализации кожи рекомендуется составлять 20-25 МГц. Визуализация с помощью конфокальной микроскопии приобрела огромное значение, поскольку технологические достижения в области разрешения позволили визуализировать и количественно оценивать кожные компоненты в мельчайших деталях. Многофотонная микроскопия (MPM) и конфокальная микроскопия отражения (RCM) продемонстрировали многообещающие результаты в визуализации микроморфологии кожи. RCM стал жизненно важным инструментом для точного анализа клеточных изображений кожи человека in vivo для изучения изменений клеточных параметров, таких как размер клеток, размер ядра, морфология кератиноцитов (которая становится все более нерегулярной с возрастом или воспалением), а также для диагностики морфометрических особенностей типа коллагеновых волокон[31]. В дерме фибриллярная классификация типов коллагена, классифицируемых как гипоотражающие и гиперотражающие структуры, указывает на интенсивность и определение волокон, в результате чего гипоотражающий коллаген затрудняет идентификацию отдельных волокон по сравнению с гиперотражающим коллагеновым волокном, которое хорошо определено и волокнисто по своей природе[32]. Дальнейшая характеристика типа коллагена как тонкого сетчатого, грубого, свернутого или свернувшегося, позволяет более подробно описать коллаген кожи и изменения, наблюдаемые на протяжении всей жизни.
В элегантной серии исследований Ueda et al.[33] использовали комбинированную MPM-визуализацию и двухосное расширение ткани, чтобы показать in vivo3-мерную архитектуру организации коллагеновых волокон в ретикулярной дерме мужчин и женщин в возрасте от 36 до 75 лет. Ткань была собрана во время реконструктивной операции. Этот метод позволил детально визуализировать волокна в ситуациях, варьирующихся от плотной упаковки переплетенных волокон до расширенной или расширенной конформации. Они показали, что в ретикулярной дерме имеются относительно крупные коллагеновые волокна с характерной волнистой морфологией, плотно упакованные, но все еще отчетливо видимые в виде переплетающихся структур с горизонтальной ламинарной организацией.Они также показали, что структура дермы изменяется по глубине, например, коллагеновые волокна толще в глубокой ретикулярной дерме и более плотно упакованы в средней зоне дермы. Эти идеи продвигают наше понимание фундаментальных механизмов, лежащих в основе роли коллагена в определении податливости кожи человека.
Выработка коллагена на протяжении всей жизни
Выработка коллагена впервые начинается в утробе матери примерно на 5-й неделе первого триместра беременности, в это время у развивающегося плода можно наблюдать тонкие коллагеновые фибриллы[34]. В ходе последующего развития коллагеновая матрица увеличивается и связана с более крупными фибриллами, собираемыми в более крупные пучки. Уже на 15 неделе беременности можно различить отдельные участки папиллярной и ретикулярной дермы. Содержание коллагена I типа составляет приблизительно 70-75%, по сравнению с коллагеном III типа, который составляет приблизительно 18-21% от общего содержания коллагена во всех гестационных возрастах. Этот уровень коллагена I типа ниже, чем измеряется в коже взрослого человека (~ 85% -90%), в то время как тип III выше, чем наблюдается в коже взрослого человека (~ 8% -11%). Считается, что эта разница отражает более высокие требования к производству коллагена для поддержки развивающейся сосудистой сети и иннервации плода. Сообщалось, что активность ферментов, необходимых для синтеза коллагеновых волокон, изменяется с возрастом, например, активность ферментов гидроксилаз и глюкозилтрансферазы была максимально выражена в коже плода, сохраняя более высокий уровень активности в коже маленьких детей по сравнению со взрослыми[35].
В детстве, на этапах препубертатного роста и пубертатных изменений, вызванных выработкой половых гормонов у подростков, происходит быстрый и обширный оборот коллагена. Большинство публикаций по производству коллагена у подростков препубертатного и пубертатного возраста посвящено коллагену I типа, используемому в качестве органического опорного матрикса, который минерализуется для развития костей. Коллаген постоянно синтезируется, закладывается в ECM, только для того, чтобы быть разрушенным ферментами, в частности MMPs, в сбалансированном цикле, который позволяет расти. Этот оборот коллагена происходит быстро во время развития, а затем затихает во взрослом возрасте, но снова увеличивается в более позднем возрасте, чтобы компенсировать накопленные вредные повреждения, связанные с хроностарением и фотостарением[36,37]. Таким образом, синтез и деградация коллагена являются точно контролируемыми и биохимически сложными процессами, которые имеют решающее значение для развития тканей, восстановления тканей после повреждения и поддержания тканей в различных анатомических и физиологических системах.
Старение кожи является результатом ряда различных процессов, которые влияют на многие компоненты кожи и, следовательно, на ее внешний вид. Существует два основных механизма старения кожи, называемых внутренними и внешними. Эти внутренние процессы контролируются преимущественно генетическими и гормональными изменениями, в то время как внешние компоненты включают курение, употребление алкоголя, хроническое воздействие солнца, стресс и ряд других факторов. Внешне состаренная кожа характеризуется несколькими клиническими проявлениями, включая наличие тонких линий и повышенное образование морщин, снижение отдачи, повышенную хрупкость кожи и изменение меланогенеза и пигментации кожи.
Доля типов коллагена в коже меняется с возрастом[38]. Молодая кожа состоит на 80% из коллагена I типа и примерно на 15% из коллагена III типа[39]. С возрастом способность пополнять коллаген естественным образом снижается примерно на 1,0% -1,5% в год. Это снижение содержания коллагена является одним из характерных признаков, связанных с появлением тонких линий и более глубоких морщин [рис. 5]. Кроме того, глубоко внутри дермы фибриллярные коллагены, эластиновые волокна и гиалуроновая кислота, которые являются основными компонентами внеклеточного матрикса, претерпевают отчетливые структурные и функциональные изменения.
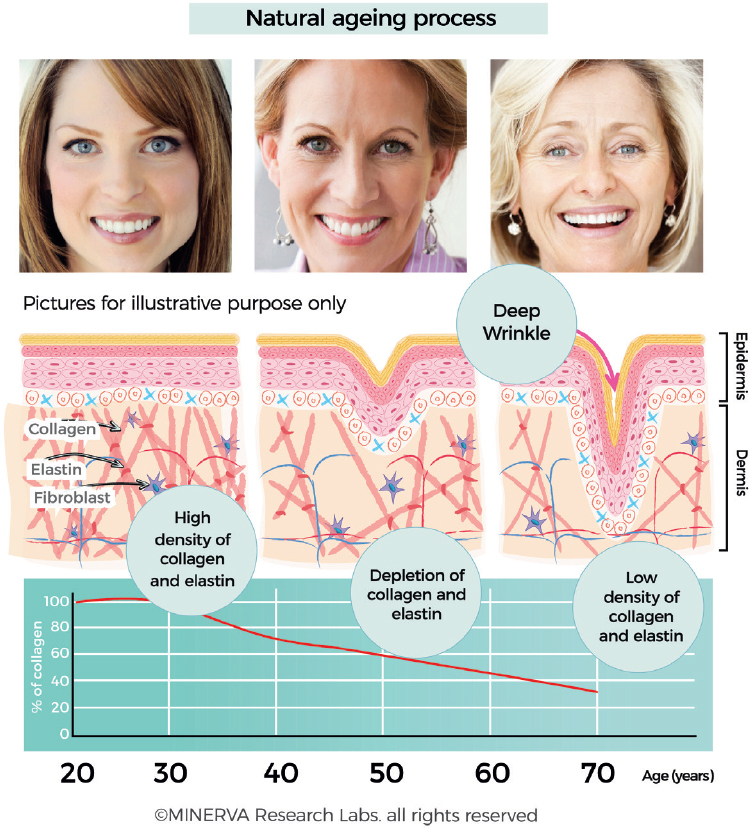
Рис. 5. Содержание коллагена в коже максимально между 2-м и 3-м десятилетием, после чего происходит медленное истощение и потеря коллагена (и связанных с ним компонентов ECM, таких как эластин и кляпы). Потеря коллагена четко коррелирует с изменениями атрибутов внешнего вида, которые обычно называются тонкими линиями и морщинами. (С разрешения MINERVA Research Labs Ltd — Лондон)
Коллаген и эластин являются стабильными белками с периодом полураспада, измеряемым в годах (t1/2 для коллагена кожи составляет приблизительно 15 лет), и, следовательно, предрасположены к длительному клеточному стрессу[40]. При рассмотрении коллагенового пучка очевидно, что основная часть коллагенового белка недоступна из-за тесной упаковки отдельных фибрилл. Даже во внешней оболочке белки химически сшиты с волокнами внутри пучка и, таким образом, не легко расщепляются протеазами. Это подчеркивает важность ферментов ММП, которые могут расщеплять тройную спираль коллагена и делать волокно доступным для ферментов деградации и клеточной рециркуляции[41].
В семействе ММП именно коллагеназы необходимы для выполнения первой стадии деградации, на которой волокна расщепляются на характерные фрагменты ¼ и ¾ [рис. 6]. Согласно модели Лауэра-Филдса, расщепление происходит на границе плотной области тройной спирали (с высоким содержанием иминокислоты) и рыхлой области тройной спирали (с низким содержанием иминокислоты), где фермент может разматывать нити тройной спирали и инициировать гидролиз отдельных нитей[42]. После этого первого шага другие протеиназы продолжают деградацию коллагеновых волокон, включая желатиназу (ММП-2), сериновые протеиназы, цистеиновые протеиназы и аспарагиновые протеиназы.
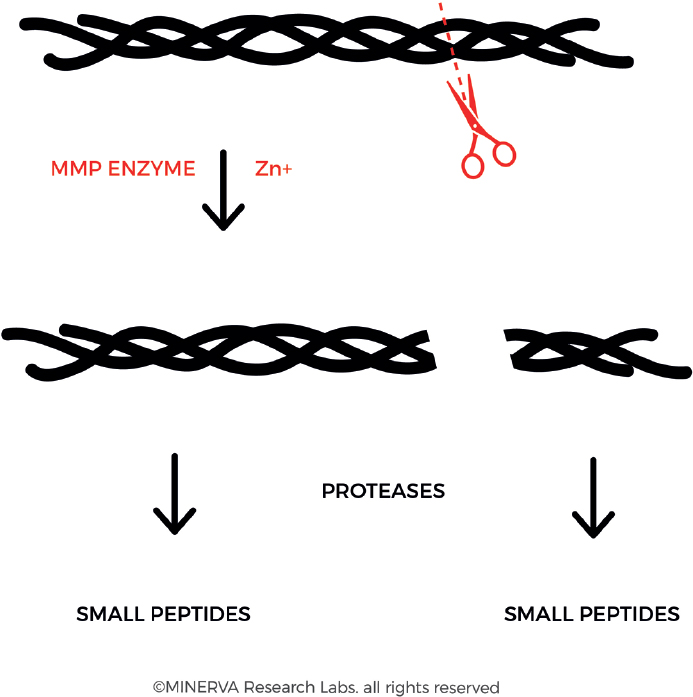
Рис. 6. Коллагеназа (также называемая матриксной металлопротеиназой, ММП) связывает и локально разматывает тройную спиральную структуру, позволяющую осуществлять последующий гидролиз открытых пептидных связей. Фермент преимущественно взаимодействует с цепью α2(I) коллагена I типа и последовательно расщепляет 3 α-цепи. Это приводит к получению характерных фрагментов 3/4 и 1/4. (С разрешения MINERVA Research Labs Ltd — Лондон)
Коллагеновые волокна со временем накапливают повреждения, и это снижает их способность правильно функционировать. Внутренне состаренная кожа, как правило, характеризуется атрофией кожи с пониженной плотностью коллагеновых волокон, эластина и гиалуроновой кислоты[43]. В дополнение к пониженной плотности, можно наблюдать, что волокна коллагена и эластина дезорганизованы и ненормальны в пожилой коже по сравнению с молодой и здоровой кожей[44]. По мере того как уровень коллагена начинает снижаться, структура коллагена становится более хрупкой и хрупкой, что приводит к ослаблению структурной поддержки кожи. Кожа теряет объем и упругость, начинает истончаться и морщиться. Снижение выработки коллагена также совпадает с потерей гиалуроновой кислоты, что еще больше влияет на увлажнение и эластичность кожи.
В исследовании , опубликованном Sibilla et al.[45], исследователи сообщили о пике содержания коллагена у испытуемых в возрасте 25-34 лет, за которым последовало постепенное снижение, равное приблизительно 25% — ному снижению в течение 4 десятилетий (процентный показатель коллагена 73,28 ± 14,3 в возрасте 25-34 лет против. 55,3 ± 13,1 в возрасте 65-74 лет, n = 64, рис. 7). Это снижение содержания коллагена в состарившейся коже было измерено с использованием различных методологических подходов, которые в целом хорошо согласуются и подтверждают гипотезу о том, что потеря коллагена является ключевым фактором, определяющим возрастное ухудшение внешнего вида кожи[46,47].
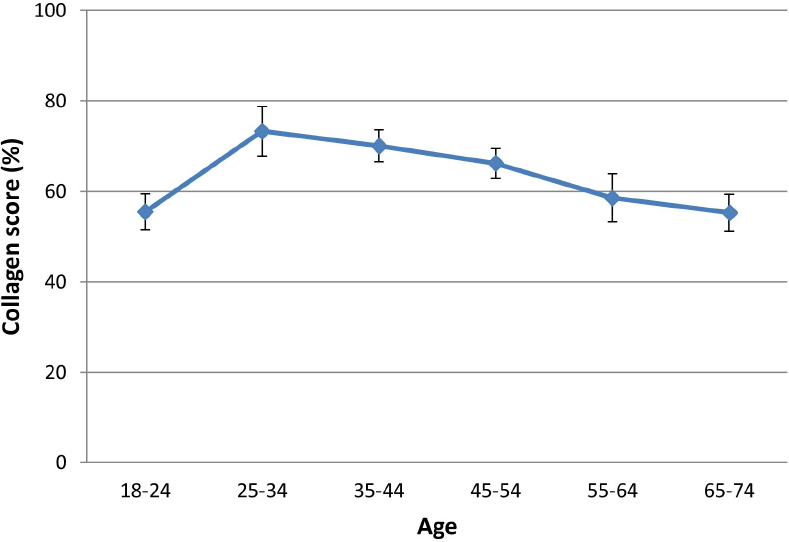
Рисунок 7. Содержание коллагена в коже имеет тенденцию к увеличению примерно до середины 20-х годов. После этого происходит прогрессирующая потеря коллагена в течение десятилетий. (С разрешения MINERVA Research Labs Ltd — Лондон)
Эндокринная система и гормональное воздействие на коллаген кожи
Изменения уровня гормонов, связанные с хроностарением, по-разному влияют на различные части тела. При гормональных изменениях в подростковом возрасте и в период полового созревания многие подростки испытывают угревую сыпь, вызванную взаимодействием гормонов, масел на основе кожного сала и резидентных бактерий и связанную с воспалением, покраснением и пятнами. Акне может быть тяжелым в клинической картине и может вызвать рубцевание кожи. Рубцевание кожи требует ремоделирования тканей, включая ремоделирование ЭЦМ на основе коллагена, для восстановления повреждений, связанных с длительным воспалением и атрофией тканей.
Повышение гормонального уровня сопровождается повышенной активностью сальных желез, особенно с увеличением содержания андрогенов, что приводит к избытку кожного сала, вырабатываемого в коже. В раннем взрослом возрасте уровень гормонов начинает снижаться, поэтому симптомы акне начинают уменьшаться. Однако поражения лица могут поражать людей на протяжении всей их взрослойжизни [48,49]. Женщины могут неоднократно страдать от прыщей во взрослом возрасте, так как это может произойти во время менструации, особенно у тех, кто страдает СПКЯ (синдром поликистозных яичников). Это гормональное расстройство влияет на менструальный цикл и может увеличить тяжесть акне. Большинство женщин страдают от угревой сыпи до периода менопаузы, когда уровень эстрогена начинает быстро снижаться[50].
Несколько исследований показали, что соблюдение здоровой и сбалансированной диеты может помочь в лечении акне, особенно пищи, богатой витамином А, витамином D, витамином В3 и витамином В5, которые помогают уменьшить воспаление, повреждения и шрамы[51]. Ниацинамид, или витамин В3, обычно используется для уменьшения отеков и покраснений из-за его противовоспалительных свойств, а также помогает регулировать количество масла, вырабатываемого сальными железами в коже. Кроме того, ниацинамид регулирует тонус кожи, помогает минимизировать следы на коже и уменьшить появление гиперпигментации[52]. Клинические исследования с использованием ежедневных пероральных добавок, содержащих пантотеновую кислоту, у здоровых взрослых людей с легкими и умеренными угрями показали снижение общего количества угрей и пятен на лице через 8 и 12 недель соответственно по сравнению с контролем плацебо[53,54]. Было показано, что дефицит витамина D (25 гидроксивитамина D3) коррелирует с увеличением тяжести поражения акне, которое может быть смягчено приемом перорального холекальциферола в дозе 1000 МЕ/сут в течение 2 месяцев[55].
Изменения в синтезе и деградации коллагена во время беременности и после родов сыграли важную роль в понимании оборота коллагена в ремоделировании ECM. Коллаген и эластин претерпевают заметное увеличение во время беременности с последующим быстрым снижением во время инволюции[56]. Беременные женщины могут испытывать множество кожных деформаций, включая растяжение кожи и выпадение волос (которые могут быть до или после родов), в то время как эластичность кожи после родов должна быть восстановлена, помогая подтянуть кожу в области живота. По мере прогрессирования беременности кожа вокруг области живота, бедер, бедер и груди расширяется, и у многих женщин появляются растяжки. Растяжки во время беременности (striae gravidarum) часто встречаются на более поздних стадиях, поражая до 90% женщин, и зависят от вязкоупругих сил натяжения кожи. Во время беременности гормоны смягчают коллагеновые волокна, уменьшая связь между ними и увеличивая появление растяжек[57]. Дряблая кожа в области живота очень распространена, и кожа может никогда не вернуться к своей первоначальной эластичности.
Другие формы растяжек (striaedistensae ; striae rubrae) представляют собой линии или полосы на коже, обычно довольно узкие и могут быть розовыми, красными или фиолетовыми[58]. Они обычно начинают темнеть и со временем исчезают, оставляя бледные следы и линии на коже. Наиболее пораженными областями являются живот, грудь и бедра. Растяжки также вызваны внезапным ростом, увеличением веса (например, ожирением) или половым созреванием.
Добавки коллагена во время и после беременности (в частности, во время грудного вскармливания) могут быть ключевой полезной поддержкой огромного количества изменений, которые организм претерпевает в течение этого периода, поддерживая увлажненную и более эластичную архитектуру кожи, делая ее более здоровой и сильной, особенно после родов. Он также имеет множество преимуществ для суставов, связок, мышц, которые помогут выносить ребенка во время беременности и помогут облегчить боль в мышцах и травмы.
Начиная с новаторской работы Олбрайта и др.[59] в 1941 году, связь между атрофированной кожей, менопаузальным статусом женщин и распространенностью остеопороза широко изучалась. Было показано, что уменьшение толщины кожи и содержания коллагена происходит с уменьшением концентрации эстрогена[60]. Симптомы, связанные с менопаузой, включают приливы жара, бессонницу, снижение эластичности кожи, снижение увлажнения кожи, варикозное расширение вен, целлюлит и нарушение когнитивных функций. Эти симптомы могут привести к разочарованию и негативно повлиять на качество жизни. Мужчины, с другой стороны, имеют постепенное снижение уровня тестостерона (что оказывает меньшее влияние на содержание коллагена) и, следовательно, испытывают меньше симптомов по сравнению с женщинами с аналогичными характеристиками и возрастом. Несколько исследований подтверждают омолаживающие свойства эстрогенов у женщин в постменопаузе, демонстрируя положительный эффект увеличения содержания коллагена в коже, толщины, эластичности и увлажнения, а также улучшения заживления ран и уменьшения раневых осложнений[61,62].
При изучении содержания коллагена в коже во время менопаузы наблюдалось среднее снижение содержания коллагена в коже на 2,1% и толщины кожи на 1,13% за каждый год постменопаузы в течение первых 15-18 лет постменопаузы[63,64]. В исследовании, проведенном на 65 женщинах разного возраста и менструального цикла, содержание коллагена было снижено у женщин в постменопаузальном состоянии [рис .8][45]. Результаты показали снижение показателя коллагена, измеренного у женщин в постменопаузе (Процентный показатель коллагена = 59,8 ± 18,1, n = 27) по сравнению с пациентами в пременопаузе (Процентный показатель коллагена = 67,9 ± 12,1, n = 38). Интересно, что при проведении исследования не было прямой корреляции между женщинами с регулярным или нерегулярным менструальным циклом (процентный балл коллагена = 67,4 ± 12,5, n = 25 и 68,9 ± 11,7, n = 13 соответственно).
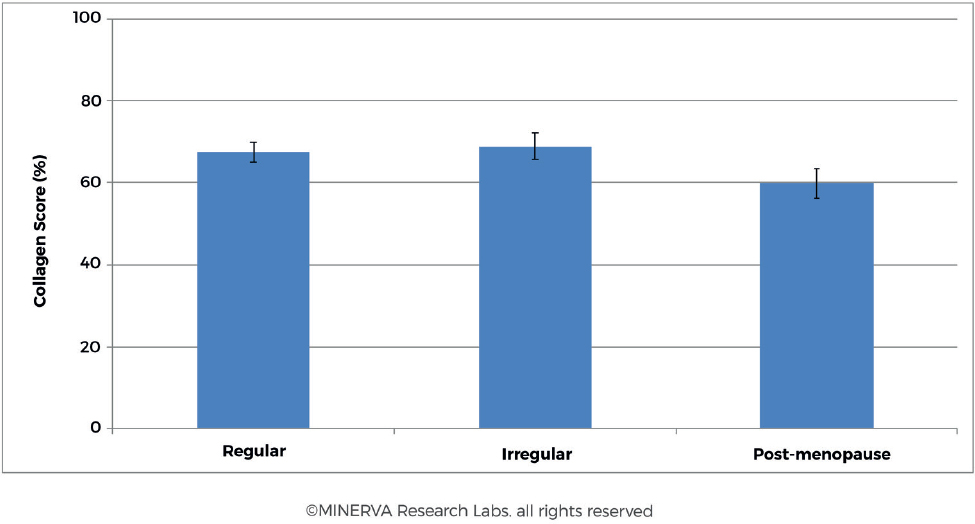
Рисунок 8. У женщин с регулярным или нерегулярным менструальным циклом не было заметной разницы в содержании коллагена в коже. Тем не менее, для когорты в постменопаузе тенденция показывает снижение содержания коллагена в коже примерно на 13%. (С разрешения MINERVA Research Labs Ltd — Лондон)
Исследователи изучили инновационные стратегии, использующие методы лечения, связанные с эстрогенами, чтобы помочь улучшить состояние кожи[65,66]. Хотя влияние эстрогена на кожу до сих пор до конца не изучено, известно, что у женщин снижение уровня эстрогена связано с различными кожными изменениями, многие из которых могут быть обращены вспять или улучшены добавлением эстрогенных веществ. Заместительная гормональная терапия (ЗГТ) — это лечение для восстановления симптомов менопаузы, обычно сочетающее эстроген и прогестерон. Он заменяет системные гормоны, которые происходят на более низком уровне по мере прогрессирования менопаузы. Ключевые преимущества ЗГТ заключаются в том, чтобы помочь восстановить коллаген в коже, облегчить приливы, уменьшить ночную потливость, контролировать перепады настроения, уменьшить сухость влагалища и другие.
Эстроген ЗГТ с прогестероном или без него использовался для лечения симптомов менопаузы и для предотвращения долгосрочных состояний, таких как остеопороз и сердечно-сосудистые заболевания. В рандомизированном плацебо-контролируемом исследовании оценивалось влияние генистеина на приливы жара у женщин в постменопаузе в течение 1 года. Показатель смыва снизился на 24% при применении генистеина по сравнению с 54% при применении синтетических аналогов гормонов, используемых при ЗГТ[67].
Изофлавоны и лигнаны являются двумя основными группами фитоэстрогенов (ПЭ). Изофлавоны-это полифенольные соединения, которые обладают свойствами как агониста эстрогена, так и антагониста эстрогена. Изофлавоновые соединения, такие как генистеин и дайдзеин, в основном содержатся в продуктах на основе сои. Генистеин является наиболее широко изученным изофлавоном, ингибитором ангиогенеза и фитоэстрогеном с антиоксидантными свойствами, благотворно влияющими на дегенеративные заболевания человека. С другой стороны, было показано, что дайдзеин увеличивает пролиферацию фибробластов в фибромышечной оболочке эпителия влагалища и в коже человека[68]. В другом двойном слепом плацебо-контролируемом клиническом исследовании исследователи изучали влияние изофлавонов на симптомы менопаузы, включая сухость кожи, волос на лице, либидо и сухость влагалища у женщин в постменопаузе в возрасте от 50 до 75 лет. Три месяца приема соевых добавок, содержащих ПЭ, не обеспечивали облегчения симптомов по сравнению с плацебо[69]. К сожалению, до сих пор недостаточно данных, чтобы понять долгосрочные последствия использования ПЭ.
Окислительное повреждение и восстановление коллагена
В процессе старения долгосрочные последствия окислительного повреждения клеток и тканей являются ключевым механизмом, на который могут быть направлены стратегии вмешательства, с тем чтобы мы могли попытаться замедлить разрушительные последствия старения. В этом контексте нарушение баланса между производством активных форм кислорода (АФК) и нашей клеточной защитой через антиоксидантную защиту определяется как окислительный стресс[11,70]. АФК-это специфическое подмножество видов свободных радикалов, которые действуют, управляя несколькими молекулярными путями, которые играют важную роль в патологических состояниях, таких как рак, болезни сердца и диабет. Повреждение солнцем (в частности, механизмы UVA-излучения, регулирующие выработку АФК) может вызвать как рак кожи, так и фотостарение, воздействуя на кожу через морщины, шелушение, сухость и пятнистую гиперпигментацию[71]. АФК могут вызывать повреждение внутриклеточных компонентов, таких как ДНК, липиды и белки. Однако кожа обладает защитными механизмами, которые взаимодействуют с токсикантами и противодействуют их повреждающему действию (включая как неферментативные, так и ферментативные молекулы, которые функционируют как мощные антиоксиданты). Эти защитные механизмы, хотя и высокоэффективны, имеют ограниченные возможности и могут быть перегружены, особенно во время старения, что приводит к повышению уровня АФК и связанному с этим повышенному риску дерматологических заболеваний.
Виды свободных радикалов определяются наличием неспаренных электронов во внешних оболочках атома или составляющих атомов молекул[72]. Эта нестабильная конфигурация будет стремиться найти электрон, либо взять (в случае ионных связей), либо разделить (в случае ковалентных связей). Высокоэнергетические свободные радикалы могут нанести большой ущерб структурным компонентам клеток (таким как мембраны липидного бислоя) или субклеточным компонентам (таким как белки, липиды или ДНК), с которыми они сталкиваются. Эти высокоэнергетические виды быстро реагируют с соседними молекулярными видами и, таким образом, имеют очень короткий период полураспада и низкую стационарную концентрацию in situ. Инициация свободных радикалов происходит, когда событие высокой энергии, например, когда фотон UVB или UVA поражает атом-мишень, лишая электрон внешней оболочки[73]. Инициация также может происходить в результате окислительного метаболизма и митохондриального дыхания в клетке. Когда свободный радикал вступает в реакцию с другой молекулой, он, в свою очередь, генерирует другой свободный радикал, что называется стадией распространения. Это вызывает цепную реакцию, которая по своей сути опасна для любой биологической системы. Заключительная стадия называется окончанием, которое завершает цепную реакцию.
Последствия и воздействие АФК зависят от способности клетки ограничивать атаку свободных радикалов и восстанавливать повреждения. В случае ДНК специфические ферменты, такие как НАД-зависимая Поли-АДФ-рибозополимераза (PARP), могут восстанавливать повреждение ДНК, предотвращая ошибки кодирования или мутации в генетическом коде[74]. Оборот липидов, как правило, высок и обеспечивает замену перекисей липидов. Однако повреждение белка может быть трудно исправить, особенно если скорость оборота белка низкая. Однако важно отметить, что повреждение белка коллагена, скорее всего, происходит по косвенному механизму. Основной биологической мишенью повреждения свободными радикалами в случае белков являются сульфидрилсодержащие виды, включая трипептид глутатиона, который имеет высокое содержание сульфидрила из-за присутствия цистеина[75,76]. Глутатион может быть переработан с использованием NADPH (восстановленной формы никотинамидадениндинуклеотидфосфата) в качестве кофактора, что делает его высокоэффективным поглотителем свободных радикалов. Однако последующее окислительное истощение глутатиона и последующий каскад воспаления приводят к увеличению транскрипции, трансляции и экспрессии ферментов ММП, которые могут повлиять на целостность ECM[77]. Как объяснялось ранее в этом обзоре, семейство ферментов матриксных металлопротеиназ (особенно ММП-1 и ММП-3) может разрушать коллагеновые волокна, приводя к потере функциональной ЭЦМ.
Один из подходов к профилактике или лечению этих АФК-опосредованных расстройств основан на введении различных антиоксидантов с целью восстановления гомеостаза. Поглотители свободных радикалов из пищевых и дополнительных источников включают водорастворимые ингредиенты, такие как витамин С (l-аскорбиновая кислота), жирорастворимые ингредиенты, такие как витамин Е (d-α-токоферол), и широкий спектр антиоксидантов, полученных из растительных продуктов, включая флавоноиды, каротиноиды и многочисленные растительные экстракты. Антиоксидантные виды защищают клетку, нейтрализуя свободные радикалы, но в процессе сами становятся видами свободных радикалов. Однако для клетки более эффективно перерабатывать, восстанавливать или регенерировать небольшие молекулярные массы, такие как аскорбиновая кислота, и это эффективно защищает более крупные молекулярные структуры, такие как белки, липиды и ДНК, от повреждений [рис. 9].
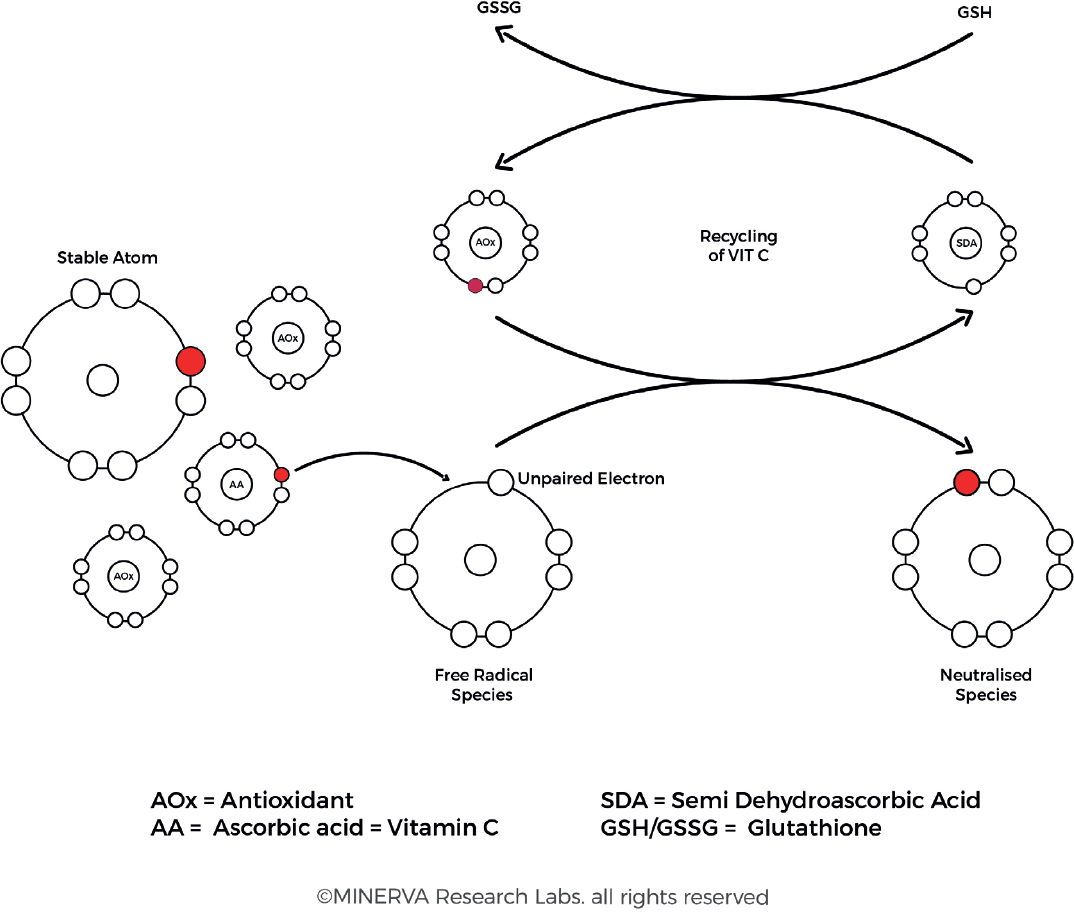
Рисунок 9. Повреждение свободными радикалами происходит, когда неспаренные электроны атакуют электроны во внешней оболочке соседнего атома. Антиоксиданты защищают клеточные компоненты, жертвуя электрон для нейтрализации свободных радикалов, после чего они могут быть переработаны, восстановлены, регенерированы или удалены. (С разрешения MINERVA Research Labs Ltd — Лондон)
Аскорбиновая кислота способна взаимодействовать с целым рядом видов свободных радикалов, способствуя их детоксикации. В этом процессе сама аскорбиновая кислота превращается в стабильный свободный радикал аскорбила, который является гораздо менее реакционноспособным видом и, следовательно, с меньшей вероятностью вызывает окислительное повреждение клеточных компонентов. Аскорбиновая кислота может быть рециркулирована через цитозольные глутатионзависимые пути или мембраносвязанные пути НАДН-зависимой редуктазы[78]. Витамин С также способен сохранять активность витамина Е путем преобразования токоферильного радикала обратно в его нативную форму, восстанавливая биологическую активность видов токоферолов[79].
Важно понимать, что угроза АФК целостности и содержанию коллагена в ECM может создаваться многими различными путями. В дополнение к УФ-излучению, другие механизмы включают образование конечных продуктов гликирования (ВОЗРАСТ), конечных продуктов окисления липидов (АЛЭ), диету и образ жизни, потребление алкоголя, курение или связанный с загрязнением метаболизм ксенобиотиков, который может быть связан с производством полициклических ароматических углеводородов[70].
Внутри белковой основы коллагена могут происходить ранние реакции гликирования, в которых глюкоза реагирует неферментативным и обратимым образом со свободными аминогруппами лизина. Хотя эта реакция обратима, при кумулятивном окислительном стрессе комбинация гликирования и окисления образует необратимые аддукты с белком, которые в конечном итоге становятся ВОЗРАСТНЫМИ, в частности, в виде аддуктов карбоксиметиллизина и пентозидина [рис .10][40]. В отличном, но связанном механизме АЛЭ, включающий полиненасыщенные жирные кислоты в качестве основной мишени для атаки свободных радикалов, приводит к образованию перекисных радикалов липидов, гидропероксидов липидов и альдегидных продуктов [рис. 11]. Малонового диальдегида (МДА) и 4-гидрокси-2-nonenal (4-СДС) являются ключевыми продуктов окисления липидов и могут реагировать со свободными аминогруппами коллагена белка, в очередной раз преимущественно лизина, как и в других классических аминокислот, которые подвержены реагируют с МДА и 4-NHE (гистидин и цистеин) отсутствуют в коллаген в значительных количествах[71]. Из-за медленного оборота коллагена повреждения могут накапливаться годами и десятилетиями. Кумулятивное повреждение белков коллагена в ЭЦМ из-за ЭЛЕ и возрастных видов нарушает их нормальную структуру и метаболизм и приводит к повышенной жесткости и ригидности и потере функций.
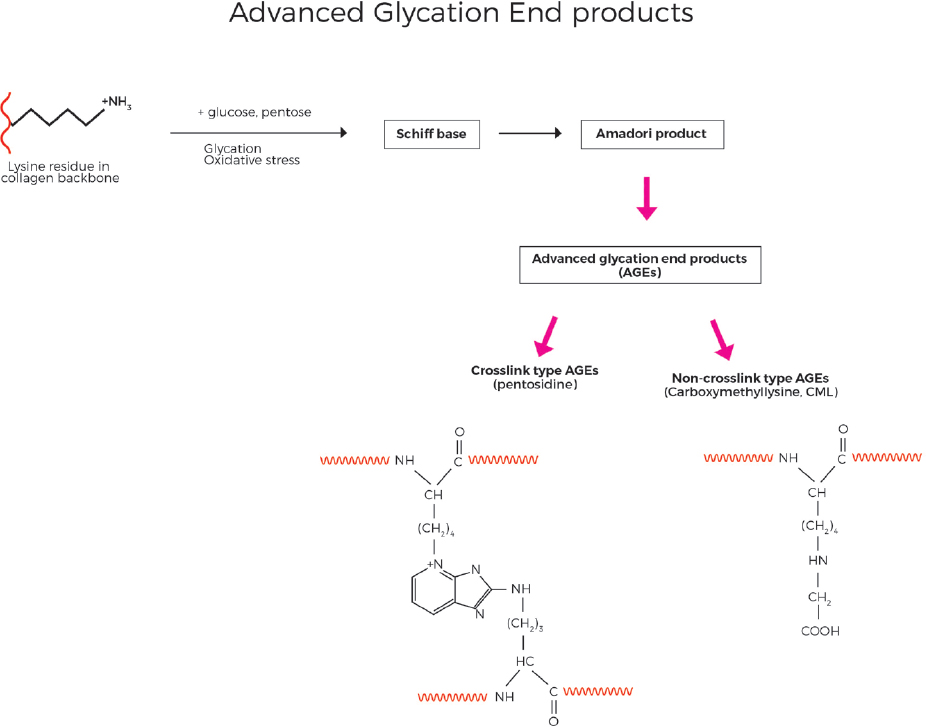
Рисунок 10. Продвинутый конечный продукт гликирования (ВОЗРАСТ) образуется, когда сахара, такие как глюкоза или пентоза, вступают в реакцию с остатками лизина в коллагеновой основе, что в конечном итоге приводит к образованию либо видов возраста без сшивки типа, таких как ХМЛ, либо возраста типа сшивки, таких как пентозидин. (С разрешения MINERVA Research Labs Ltd — Лондон)
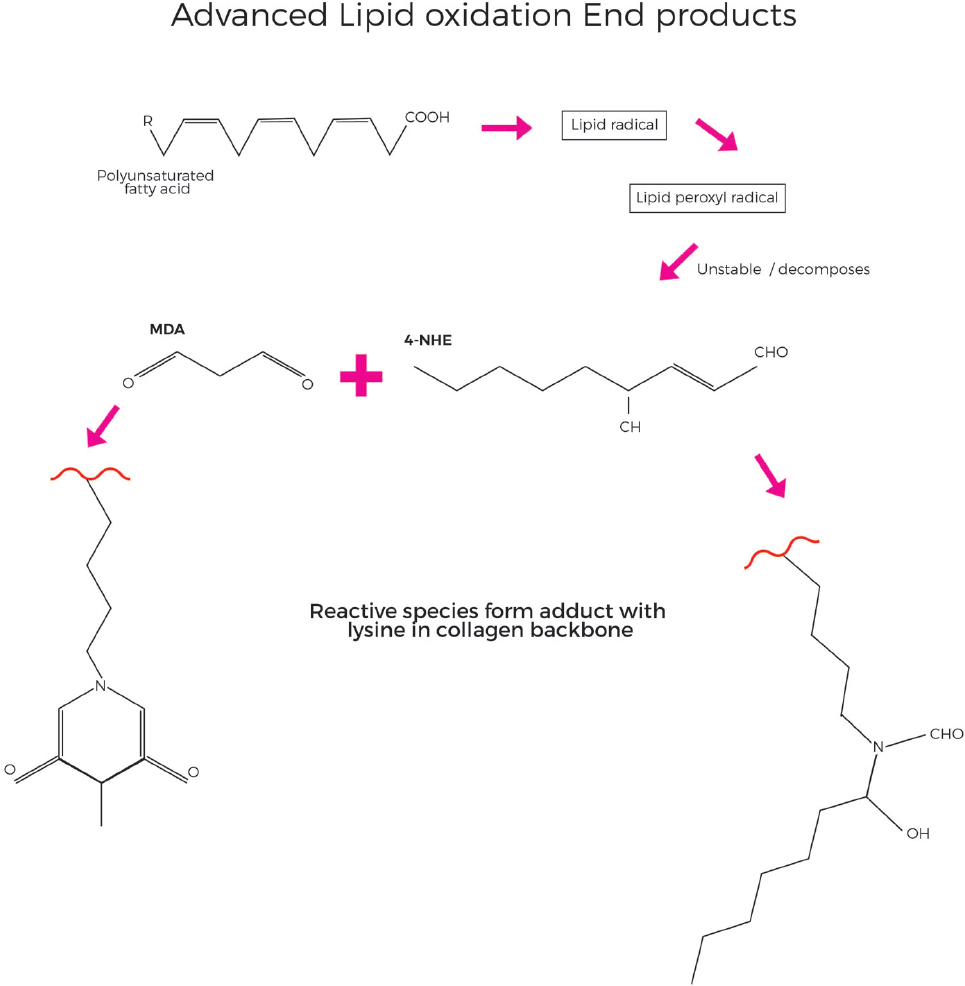
Рисунок 11. Продвинутые конечные продукты перекисного окисления липидов (АЛЭ) образуются при окислении полиненасыщенных жирных кислот, образуя виды липидных радикалов, которые могут привести к образованию реактивных веществ, таких как МДА (малоновый диальдегид) или 4-ННЕ (4-гидрокси-2-ноненал), которые вступают в реакцию с остатками лизина в коллагеновой основе, что приводит к кумулятивному повреждению в течение длительных периодов времени. (С разрешения MINERVA Research Labs Ltd — Лондон)
Используя хорошо сбалансированную комбинацию как водорастворимых, так и жирорастворимых антиоксидантов в добавках, разработанных для обеспечения оптимального поглощения, распределения по сосудам и клеточной биодоступности, можно замедлить старение кожи и улучшить состояние кожи[80].
Стратегии борьбы со старением, связанные с коллагеном кожи
Сообщалось, что здоровье и красота кожи являются основными факторами, отражающими общее благополучие и связанное с этим восприятие здоровья потребителями[81]. Различия между хроновозрастной кожей (которая имеет тенденцию быть тонкой, сухой и мелко морщинистой) и кожей фотостарения (которая имеет тенденцию быть утолщенной, гиперпигментированной, глубоко морщинистой и демонстрирующей грубую профилометрическую топографию) позволяют разрабатывать стратегии целенаправленного вмешательства. Исследование Фонда Макартура по успешному старению было названо “новой геронтологией” и пропагандировало потенциал здоровой и активной старости[82,83]. Это альтернативный взгляд на старую парадигму “упадка и потерь”, которая рассматривает старение как серию индивидуальных сокращений или потерь, к которым как пожилые люди, так и общество должны были адаптироваться или приспособиться. В поддержку обеих этих концепций было высказано желание свести к минимуму видимые признаки старения кожи.
Стимуляция выработки коллагена и/или ингибирование деградации коллагена может быть достигнуто несколькими способами, включая использование хирургических эстетических процедур, местного лечения или использование пероральных добавок (часто называемых “нутрикосмецевтиками”). В докладе, опубликованном Европейским союзом, критическая важность питания в активном и здоровом старении была четко описана как для макронутриентов, так и для микронутриентов[84]. Связь между питанием и старением кожи также была подробно рассмотрена Schagen et al.[85]. Из 11 путей/стратегий вмешательства, упомянутых в этом обзоре, 7 напрямую связаны с содержанием коллагена в коже, подчеркивая важность этого белка для целостности кожи и старения.
Напитки с добавками, содержащие гидролизованные биоактивные пептиды коллагена в сочетании с витаминами, минералами и растительными антиоксидантами, часто используются в нутрикосмецевтических продуктах для улучшения эластичности кожи, увлажнения и видимых признаков тонких линий и морщин[86-89]. Кроме того, исследования показали преимущества для роста ногтей и уменьшения симптомов, связанных с сломанными, ломкими или расщепленными ногтями[90].
Все белки и пептиды должны быть гидролизованы в кишечнике, чтобы обеспечить всасывание в кровоток и транспортировку по всему организму [рис.12]. После приема внутрь частично гидролизованные пептиды коллагена в добавках далее перевариваются и гидролизуются в кишечнике[91]. Это осуществляется действием кислой среды в желудке, а также действием специфических ферментов в кишечнике (трипсин, химотрипсин, эластаза, карбоксипептидаза), которые расщепляют пептиды коллагена на более мелкие фрагменты молекулярной массы. Пептиды постепенно расщепляются по мере их поступления в кишечник и прохождения через него с образованием небольших пептидов (обычно ди — и три-пептидов) и свободных аминокислот. Было подсчитано, что 90% поглощенных белков представлены в системе кровообращения в виде аминокислот, где только 10% присутствуют в виде ди — или трипептидов[92,93]. Эта ферментативная обработка облегчает клеточное поглощение, как правило, через белки-переносчики (такие как системы котранспортера аминокислот или низкоаффинный пептидный транспортер высокой емкости PEPT1) для доставки питательных веществ из просвета в клетки энтероцитов и через базолатеральную мембрану энтероцитов в кровоток.
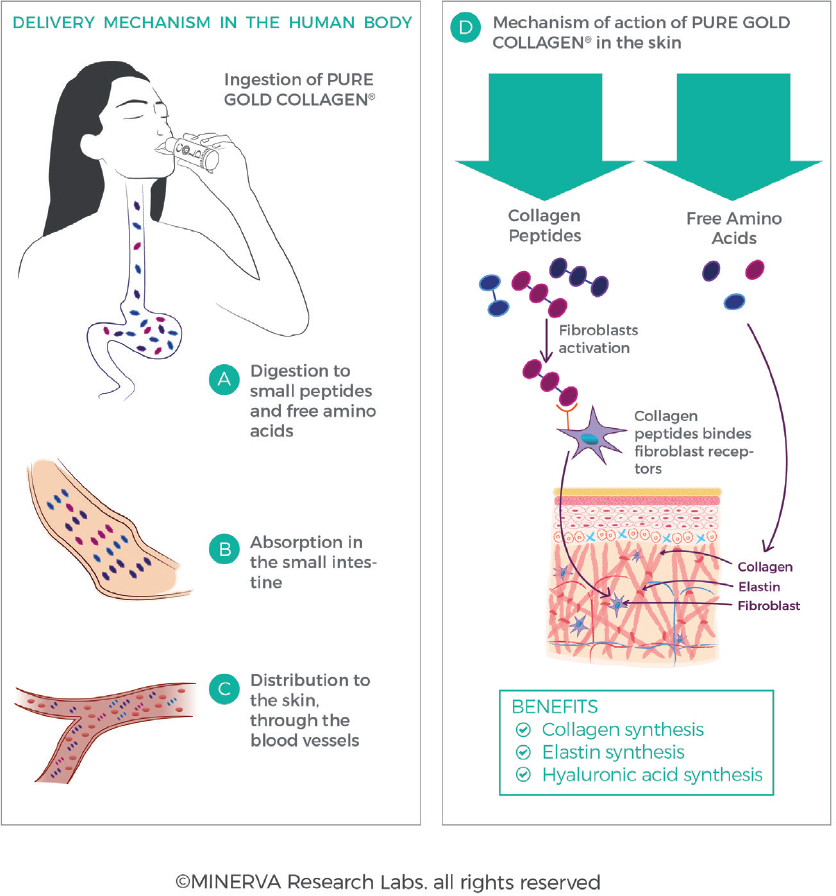
Рис. 12.Коллагеновый белок, интактный или частично гидролизованный, ферментативно гидролизуется в кишечнике до аминокислот, дипептидов и трипептидов, что позволяет транспортироваться через стенку кишечника и в кровоток (А,В,С). Перфузия пептидов и аминокислот и биодоступность в ECM позволяют стимулировать синтез фибробластов и коллагена (D). (С разрешения MINERVA Research Labs Ltd — Лондон)
Из жидкого формата ингредиенты легко всасываются в кровоток (обычно примерно через 20 минут после приема внутрь). Для сравнения, усвоение твердой пищи может занять несколько часов. Подобно процессу переваривания и всасывания белков, большинство минералов, витаминов и других питательных веществ (например, сахара, липиды) всасываются в кровь в виде простых соединений[94]. Из кровотока эти ингредиенты затем распределяются по всему телу. Перфузия микроэлементов из капиллярных петель в кожу создает микроокружение, обогащенное питательными веществами, которое омывает дерму.
Гидролизованный коллаген обладает 2 различными, но взаимодополняющими функциями. Во-первых, аминокислоты, образующиеся в результате гидролиза коллагена в желудочно-кишечном тракте, являются строительными блоками, используемыми клеткой фибробластов для производства большего количества коллагена. Поскольку коллаген уникально богат глицином, пролином (и гидроксипролином, который получают путем посттрансляционной модификации во время синтеза коллагена), это представляет собой обогащенный запас специфических аминокислот, необходимых для создания новых коллагеновых фибрилл. Во-вторых, уникальные олигопептидные последовательности, особенно дипептиды, содержащие гидроксипролин, как известно, стимулируют фибробласты через рецептор-опосредованные пути активации, чтобы индуцировать синтез новых коллагеновых волокон[95]. Хотя пептиды присутствуют на более низких уровнях, чем аминокислоты, они могут стимулировать рецепторы фибробластов и, таким образом, являются биологически мощными даже при более низких абсолютных концентрациях.
Биологическая эффективность и клиническая эффективность гидролизованного коллагена могут быть связаны как с его уникальным аминокислотным профилем, так и со специфическими олигопептидными последовательностями, что подчеркивает ключевые характеристики, способствующие большому успеху гидролизованного коллагена в качестве добавки для пользы для здоровья в организме. Другие белки, например из казеина, арахиса или тофу, имеют другой аминокислотный состав и имеют меньший относительный вклад специфических аминокислот, необходимых для рибосомального синтеза белка (который использует фермент, аминоацил тРНК-синтазу, для присоединения соответствующей аминокислоты через эфирную связь). Соответствующий комплекс тРНК используется для синтеза белка на рибосомах эндоплазматического ретикулума клетки[96,97]. Поскольку коллаген является наиболее распространенным белком ECM, виды тРНК должны быть обогащены соответствующими протеиногенными предшественниками для синтеза коллагена. Однако эта ситуация осложняется тем фактом, что аминокислоты, такие как глутамин, глутамат и аспартат, сильно метаболизируются в кишечнике и не появляются в заметных количествах в кровотоке. Всесторонний обзор, проведенный Альбо и соавт.[98], исследует исследования, в ходе которых добавки со специфическими аминокислотами, такими как пролин, были проведены для стимуляции синтеза коллагена, но доказательство превосходной эффективности гидролизованного коллагена требует дальнейших исследований.
Во время пищеварения многие ди — и три-пептиды образуются in situ. В принципе, из 18 протеиногенных аминокислот можно получить 324 дипептида или 5832 трипептида. Даже если учесть обогащение видов глицина, пролина и гидроксипролина, количество пептидов, которые потенциально могут стимулировать фибробласты к синтезу новых коллагенов, слишком велико, чтобы тестировать их in vivo. Исследования показали, что значительные количества ди — и трипептидных видов, Pro-Hyp, Ala-Hyp, Ala-Hyp-Gly, Pro-Hyp-Gly, Leu-Hyp, Ile-Hyp и Phe-Hyp были измерены в крови человека после перорального приема различных гидролизатов коллагена[95-100]. Было показано, что некоторые из этих ди — или три-пептидов стимулируют фибробласты in vitro[101,102]. Однако на сегодняшний день не доказана превосходящая эффективность отдельных или синтетических пептидов по сравнению со сложной смесью олигопептидов, образующихся при переваривании коллагена. До тех пор, пока такое доказательство не будет предоставлено, лучше продолжать использовать гидролизованный коллаген, обработанный через пищеварительную систему, в качестве источника пептидов, стимулирующих фибробласты. Аналогичным образом, актуальные продукты, использующие коллагеновые пептиды, не могут обеспечить такой широкий спектр биологически активных пептидов, в дополнение к проблемам чрескожной абсорбции олигопептидов через роговой слой, будучи ограниченными.
Выражение “Витамины красоты” было применено к нескольким витаминам, но важность витамина С для кожи уникальна тем, что аскорбиновая кислота может действовать как кофактор для нескольких ферментов в производстве коллагена, в дополнение к своей роли антиоксиданта в защите от повреждения свободными радикалами. Было показано, что важность витамина С в производстве функциональных коллагеновых волокон зависит от его использования в качестве кофактора при гидроксилировании остатков пролина в проколлагене (который стабилизирует структуру тройной спирали) и остатков лизина (которые используются для сшивания волокон, придающих структурную жесткость и стабильность). Гидроксилирование катализируется Fe(II)-зависимыми диоксигеназами в случае пролильных и лизилгидроксилаз[103]. Ферменты коллагеновой пролил-4-гидроксилазы (C-P4H) катализируют образование 4-гидроксипролина (4-Hyp) на коллагенах путем модификации остатков пролина в положении Y (последовательности X-Y-Gly) в процессе, требующем Fe2+, молекулярного кислорода и аскорбиновой кислоты[104]. Эта модификация происходит в эндоплазматическом ретикулуме до образования тройной спирали коллагена. Содержание 4-Hyp является ключевым фактором, определяющим стабильность тройной спирали коллагена, без которой могут проявиться такие состояния, как цинга.
Как видно на рис. 3, в эндоплазматическом ретикулуме клетки фибробластов специфические остатки лизина гидроксилируются ферментом лизилгидроксилазы с образованием гидроксилизина. Специфические остатки гидроксилизина пептида проколлагена могут подвергаться О-связанному гликозилированию либо с галактозилгидроксилизином, либо с глюкозилгалактозилгидроксилизином под действием соответствующих ферментов трансферазы[105].
Модификация остатков лизина имеет решающее значение для заключительной стадии ковалентного внутримолекулярного и межмолекулярного сшивания, которое придает прочность, жесткость и долговечность коллагеновому волокну [рис. 3][106]. Коллаген I типа имеет только 4 места, в которых происходит этот процесс, т. Е. 2 телопептидных участка на обоих концах пептида и 2 участка тройной спирали вдоль пептидной основы. Существует 2 пути, используемых для сшивания коллагена, один из которых основан на образовании альдегида, полученного из лизина, а другой-на образовании альдегида, полученного из гидроксилизина[25]. Первые пути являются ключевыми для генерации ЭЦМ кожи на основе коллагена.
Во внеклеточном пространстве остатки лизина N — и С — телопептидов могут быть окислительно дезаминированы с образованием активных альдегидов за счет активности лизилоксидазы[105]. Лизилоксидаза-это металлофермент меди, требующий витамина В6 (пиридоксальфосфат) в качестве кофактора, который может превращать аминную боковую цепь лизина (и/или гидроксилизина) в соответствующий альдегид. Затем эти реакционноспособные формы могут подвергаться ряду неферментативных реакций конденсации с гидроксилизином, расположенным вдоль пептидного остова, с образованием ковалентных внутримолекулярных и межмолекулярных поперечных связей [рис.3]. Хотя эта последовательность ферментативных модификаций на первый взгляд кажется сложной, это элегантная система, которая позволяет заключительным стадиям сшивания крупных коллагеновых волокон происходить вне клетки и в ECM, что позволяет сформировать большой структурный белковый каркас и эластичный матрикс, который поддерживает кожу.
Атрибуты внешнего вида кожи
Как говорится, “красота в глазах смотрящего”, предполагая, что это субъективный, перцептивный когнитивный процесс, который трудно измерить и количественно оценить. Однако красота-это конструкция видимых и измеримых физических особенностей, которые определяют внешность. Таксономия признаков внешнего вида была подробно рассмотрена Igarashi et al.[107] и может быть классифицирована на основе компонентов кожи, измеренных в 3 различных масштабах, микро -, мезо-и макроуровне, в порядке увеличения размера. Каждая шкала может быть охарактеризована более подробно с помощью методов обнаружения с высоким разрешением, которые могут быть дополнительно соотнесены с физиологией и анатомией. Таким образом, атрибуты внешнего вида кожи можно рассматривать на нескольких различных уровнях, каждый из которых связан с красотой в зависимости от применяемых результатов.
Микромасштабность определяется различными клеточными элементами и слоями кожи, в которых размеры этих субклеточных органелл, как правило, очень малы и поэтому едва заметны невооруженным глазом наблюдателя. Это включает в себя клетки и волокна, и их оптические взаимодействия с падающим светом зависят от оптических явлений, таких как рассеяние и поглощение. Ключевым измеряемым параметром являются показатели преломления элементов, например, коллагеновые волокна в ЭЦМ взаимодействуют с падающим пучком света, вызывая сильное рассеяние фотонов. Элементы клеточного уровня включают эпидермис, дерму и подкожную клетчатку.
Кожа и особенности кожи составляют мезо-шкалу. В этом масштабе компоненты становятся видимыми невооруженным глазом. Визуальные свойства этих компонентов в основном определяются оптическими явлениями, которые индуцируются более мелкими масштабными компонентами. Кожа состоит из наружных слоев роговицы, липидов поверхности кожи, выступающих волосяных фолликулов, тонких линий и более глубоких морщин, характеристики которых могут быть дополнительно определены пигментами. Другие особенности кожи, такие как гиперпигментированные пятна (например, солнечные лентигины) и поры (например, эккриновые железы, сальные протоки), также способствуют общему внешнему виду и восприятию ровности цвета лица.
Области тела и части тела классифицируются как макромасштабные. Внешний вид кожи варьируется в разных областях тела. Это связано с тем, что физико-анатомические характеристики компонентов более низкого уровня могут значительно отличаться от одной области тела к другой. Эффекты основных особенностей опорно-двигательного аппарата более заметны, например, отсутствие черт на туловище по сравнению с различными анатомическими структурами, видимыми на лице и шее.
В открытом исследовании на 217 добровольцах женского пола пищевая добавка (Pure Gold Collagen®) была протестирована на ее способность уменьшать видимые признаки старения и сравнивалась с эффектами эстетического хирургического вмешательства, такого как ботокс, лазерное лечение или использование дермальных наполнителей[108]. В исследовании сообщалось об улучшении состояния лица в носогубных складках, которые простираются от стороны носа до уголков рта. Эти складки обычно углубляются с возрастом, и поскольку они более заметны, чем другие линии лица, их глубина является полезным параметром для измерения эффекта омолаживающих средств. Сообщалось о снижении среднего балла на 24% по сравнению с исходным уровнем, как это было определено экспертом-визуальным экспертом. У 37% испытуемых наблюдалось значительное улучшение глубины носогубной складки при снижении среднего балла на 44%. Интересно, что сопоставимое значительное уменьшение глубины носогубной складки было зарегистрировано независимо от того, подвергались ли субъекты хирургическому лечению области носогубной складки или нет. Через 60 дней у пациентов, прошедших другие косметические процедуры, наблюдалось уменьшение глубины носогубной складки, причем дерматологи сообщили о снижении на 15% для лазерных процедур, на 50% для ботокса, на 28% для наполнителей, на 41% для процедур в области носогубной складки и на 18% и 10% для мезотерапии и дермабразии, соответственно. В группе испытуемых, которым была проведена дермабразия, лазерная обработка лица или ботокс в верхней части лица для устранения глабеллярных линий или гусиных лапок, наблюдалось соответствующее уменьшение видимости носогубных складок на 4%, 12% и 18%. Неудивительно, что наибольшее сокращение числа морщин класса 2 наблюдалось у испытуемых, у которых в носогубных складках были наполнители (29%). Также было отмечено уменьшение морщин 2-го класса среди тех, кто проходил мезотерапию или терапию плазмой, богатой тромбоцитами (25%). В группе испытуемых, у которых было увеличение щек или губ с помощью наполнителей, наблюдалось уменьшение морщин 3-го класса на 25%.
Независимое двойное слепое, рандомизированное, плацебо-контролируемое клиническое исследование было проведено исследование воздействия на коллаген-добавка на основе (золото коллаген® Форте) на коже упругость по предметам, которые прошли косметическое лечение (филлеров и ботокса в лицевую районы) и субъектов, которые не при использовании этой пищевой добавки в течение 90 дней[11,109]. Исследование показало статистически значимое увеличение эластичности кожи после 90 дней лечения, и увеличение эластичности кожи наблюдалось исключительно как у пациентов, которые прошли косметическое лечение, так и у пациентов, которые этого не сделали. Кроме того, в группе плацебо не наблюдалось существенных изменений эластичности кожи, как у пациентов, которые прошли или не прошли косметическое лечение. Увеличение эластичности кожи свидетельствует о том, что эта функциональная пищевая добавка, содержащая коллагеновые пептиды среди других активных ингредиентов, оказывает влияние на восстановление правильного уровня белков внеклеточного матрикса, таких как коллаген и эластин. Кроме того, результаты показали снижение солнечного эластоза и гиперкератоза в дерме.
Будущие перспективы и возможности
Будущие возможности улучшения синтеза коллагена, образования фибрилл, целостности ECM и старения кожи зависят от активности фибробластной клетки. Однако со временем, износом, окислительным повреждением и другими клеточными воздействиями фибробласт стареет, т. е. теряет способность к репликации (репликативное старение). По мере старения фибробластов происходит уменьшение теломер (теломеры-это тандемные повторы ДНК, обнаруженные в конце хромосом и, как известно, укорачивающиеся с каждым прогрессивным циклом деления клеток). Хотя они остаются метаболически активными, стареющие фибробласты испытывают снижение своих нормальных клеточных функций. Воспаление и кумулятивное повреждение связаны с увеличением укорочения теломер, что может быть использовано в качестве биомаркера клеточного старения, геномной нестабильности и старения клеток в коже пожилых людей[110]. Это приводит к ситуации, когда кожа не способна эффективно восстанавливать поврежденный коллаген, с последующей потерей функциональной матрицы поддержки, связанной с видимыми признаками старения, такими как тонкие линии, морщины и провисание.
Как длина теломер, так и активность теломеразы могут быть измерены с помощью моделей окислительного стресса и измерения защитных эффектов антиоксидантов. Длина теломер в фибробластах кожи человека была сокращена одной высокой дозой UVA-излучения in vitro[111]. Возможно, что острое фотоповреждение может способствовать раннему фотостарению кожи человека с помощью этого механизма, включающего укорочение теломер. Однако еще предстоит выяснить, имеют ли такие механизмы отношение и к ситуации in vivo.
Поиск новых механизмов борьбы со старением фибробластов и новых биоактивных веществ, препятствующих потере теломер или восстановлению повреждений ДНК, — это захватывающая новая область исследований, которая вполне может предложить новые методы лечения в борьбе со старением кожи.
Вывод
Коллагены-это разнообразное семейство вездесущих белков с широким спектром клеточных и внеклеточных функций, поддерживающих клеточную сигнализацию, пролиферацию, дифференцировку и структурную целостность соединительных тканей. Как основной белок, содержащийся во внеклеточном матриксе кожи и костей, коллаген I типа представляет собой наиболее распространенный коллаген, обнаруженный в организме. Коллагеновые волокна могут сохраняться в коже в течение многих лет, но подвержены кумулятивному повреждению в течение всей жизни. Потеря функций, наблюдаемая как при хроностарении, так и при фотостарении, привела к появлению множества стратегий восстановления и замены коллагена, предотвращения повреждения коллагена, обеспечения витаминами и минералами для поддержки биохимических и физиологических манипуляций с оборотом коллагена и оптимизации взаимодействия с другими важными компонентами ECM, такими как эластин и кляпы. Косметическая хирургия и местные вмешательства являются важными стратегиями в борьбе с видимыми признаками старения, особенно в тех случаях, когда требуются видимые результаты в течение короткого периода времени. В долгосрочной перспективе омолаживающие преимущества могут быть усилены добавлением искусно разработанных нутрикосмецевтических добавок, с общей целью омолодить стареющую или поврежденную кожу, улучшить целостность кожи, внешний вид, красоту и поддержать личное благополучие и жизненную силу.
Эти статьи вас заинтересуют
Получить больше информации об аминокислотах
Литература:
на сегодняшний день. Доступно по адресу: https://publications.jrc.ec.europa.eu/repository/handle/JRC90454. [Последний раз обращался 26 июля 2019 года].
85. Шаген СК, Зампели ВА, Макрантонаки Е, Зоубулис СС. Открытие связи между питанием и старением кожи. Дерматоэндокринол 2012;4:298-307.
86. Ассерин Дж., Лати Э., Шиоя Т., Правитт Дж. Влияние пероральных добавок пептидов коллагена на влажность кожи и дермальную коллагеновую сеть: данные модели ex vivo и рандомизированных плацебо-контролируемых клинических испытаний. J Cosmetol 2015;14:291-301.
87. Беген А. Новая добавка микронутриентов при старении кожи: рандомизированное плацебо-контролируемое двойное слепое исследование. J Cosmeticol 2005;4:277-84.
88. Боруманд М., Сибилла С. Исследование по оценке влияния на морщины пищевой добавки с высокой дозировкой гидролизованного коллагена. Космецевтика 2014;3:93-6.
89. Боруманд М., Сибилла С. Влияние пищевой добавки, содержащей пептиды коллагена, на эластичность кожи, увлажнение и морщины. J Med Nutr Nutraceut 2015;4:47-53.
90. Hexsel D, Zague V, Schunck M, Siega C, Camozzato FO, Oesser S. Пероральные добавки со специфическими биоактивными пептидами коллагена улучшают рост ногтей и уменьшают симптомы ломкости ногтей. J Cosmetic Dermatol 2017;16:520-6.
91. Kiela PR, Ghishan FK. Физиология кишечного всасывания и секреции. Best Pract Res Clin Gastroenterol 2016;30:145-59.
92. Даниэль Х. Молекулярная и интегративная физиология транспорта пептидов в кишечнике. Annu Rev Physiol 2004;66:361-84.
93. Майнер-Уильямс ВМ, Стивенс БР, Моган Пи-Джей. Поглощаются ли интактные пептиды из здорового кишечника у взрослого человека? Nutr Res Rev 2014;27:308-29.
94. БУДЬ добрым человеком. Понимание пищеварения и усвоения основных питательных веществ у человека. Adv Physiol Education 2010;34:44-53.
95. Кляйнниенхайс AJ, van Holthoon FL, Maathuis AJH и др. Нецелевой и целенаправленный анализ гидролизатов коллагена в процессе пищеварения и всасывания. Анальная биоанальная химия 2020;412:973-82.
96. Последний JA, Reiser KM. Биосинтез коллагена. Перспектива здоровья окружающей среды 1984;55:169-77.
97. Мур ПБ. Рибосома вернулась. J Biol 2009;8:8.
98. Альбау В. Л., Мукерджи К., Барбул А. предшественники пролина и синтез коллагена: биохимические проблемы добавления питательных веществ и заживления ран. J Nutr 2017;147:2011-7.
99. Иваи К, Хасэгава Т, Тагучи У и др. Идентификация пептидов коллагена пищевого происхождения в крови человека после перорального приема гидролизатов желатина. J Agric Food Chem 2005;53:6531-6.
100. Охара Х, Мацумото Х, Ито К, Иваи К, Сато К. Сравнение количества и структуры гидроксипролинсодержащих пептидов в крови человека после перорального приема гидролизатов желатина из различных источников. J Agric Food Chem 2007;55:1532-5.
101. Постлетуэйт АЕ, Сейер Дж.М., Кан А. Хемотаксическое притяжение фибробластов человека к коллагенам I, II и III типов и пептидам, полученным из коллагена. Proc Natl Acad Sci U S A 1978;75:871-5.
102. Охара Х, Итикава С, Мацумото Х и др. Дипептид коллагенового происхождения, пролин-гидроксипролин, стимулирует пролиферацию клеток и синтез гиалуроновой кислоты в культивируемых фибробластах кожи человека. J Dermatol 2010;37:330-8.
103. Мыллихарью Дж, Кивирикко КИ. Коллагены, модифицирующие ферменты и их мутации у людей, мух и червей. Тенденции Genet 2004;20:33-43.
104. Раппу П, Сало AM, Myllyharju J, Heino J. Роль гидроксилирования пролила в молекулярных взаимодействиях коллагенов. Очерки биохимии 2019;63:325-35.
105. Ямаути М., Срихолпеч М. Посттрансляционные модификации коллагена лизином. Очерки биохимии 2012;52:113-33.
106. Миллер Э. Дж. Химия коллагена. In: Piez K, Reddi А, редакторы. Биохимия внеклеточного матрикса. Elsevier; 1984. С. 41-78.
107. Игараши Т, Нишино К, Наяр С. Внешний вид человеческой кожи. Основы и тенденции в компьютерной графике и зрении 2007;3:1-95.
108. Боруманд М., Сибилла С. Ежедневное потребление коллагеновой добавки Pure Gold Collagen® уменьшает видимые признаки старения. Clin Intervention 2014;9:1747-58.
109. Дженовезе Л, Корбо А, Сибилла С. Понимание изменений текстуры и свойств кожи после диетического вмешательства с помощью нутрикосмецевтика, содержащего смесь биоактивных пептидов коллагена и антиоксидантов. Фармакол Физиол кожи 2017;30:146-58.
110. Космадаки МГ, Гилкрест БА. Роль теломер в старении/фотостарении кожи. Микрон 2004;35:155-9.
111. Инь Б, Цзян X. Укорочение теломер в культивируемых фибробластах кожи человека связано с острым фотоповреждением, вызванным облучением UVA. Postepy Dermatol Alergol 2013;30:13-8.


